Sotyktu(Deucravacitinib)治疗银屑病(牛皮癣)临床数据及不良反应!
2022年9月9日,百时美施贵宝(BMS)公司宣布,美国FDA批准了Sotyktu(Deucravacitinib)的上市,用于适合全身治疗或光疗的中度至重度斑块型银屑病成人。此外,不建议将Deucravacitinib与其他强效免疫抑制剂联合使用。
Deucravacitinib是一种首创的、口服、选择性、变构酪氨酸激酶2(TYK2)抑制剂,其通过选择性靶向TYK2抑制IL-23、IL-12 和IFN的信号传导,而这些细胞因子都是参与多种免疫介导疾病发病机制的关键细胞因子。
Deucravacitinib通过与TYK2的调节结构域结合实现高度选择性,促成对TYK2及其下游功能的变构抑制。在生理浓度范围内,Deucravacitinib选择性地抑制TYK2;且在治疗剂量下,Deucravacitinib不会抑制JAK1、JAK2或JAK3。

图注:Deucravacitinib孟加拉ZISKA版Deucrava 6mg*30片(图片来源于网络)
Deucravacitinib是全球唯一获批的TYK2抑制剂,也是近10年来中重度斑块型银屑病口服治疗的首个创新。Deucravacitinib具有一种新的作用机制,将为中重度斑块型银屑病患者群体带来一种受欢迎的新一线口服治疗方案。
商品名:Sotyktu
通用名:Deucravacitinib
靶点:TYK2
厂家:百时美施贵宝
美国首次获批:2022年9月9日
中国首次获批:尚未获批
获批适应症:中重度斑块型银屑病
规格:6mg,片剂
推荐剂量:6 mg,每天口服一次,随餐或不随餐服用。不要压碎、切割或咀嚼药片。
储存条件:储存在20°C至25°C温度下。
临床数据
美FDA的批准是基于PEOTYK PSO-1和PEOTYK PSO-2试验的研究结果。这两项试验主要评估了Deucravacitinib(6 mg,每日一次)较安慰剂及apremilast(阿普斯特,30 mg,每日两次)用于治疗中重度斑块状银屑病患者的疗效和安全性。
在这两项试验中,共纳入了1684例患者。40%的患者之前接受过光疗,42%的患者从未接受过任何全身治疗(包括生物和/或非生物治疗),41%的患者之前接受过非生物全身治疗,35%的患者之前接受过生物治疗。

POETYK PSO-1 和 POETYK PSO-2研究的共同主要研究终点均为:与安慰剂相比,在第16周达到PASI 75(与基线相比,银屑病面积与严重程度指数评分改善至少75%)和静态医师整体评估皮损清除或几乎清除为0或1分(sPGA 0/1)的患者比例。关键次要研究终点包括与apremilast相比,在第16周和第24周达到PASI 75、PASI 90(与基线相比,银屑病面积与严重程度指数评分改善至少90%)和sPGA 0/1的患者比例。
1
PEOTYK PSO-1试验
PASI 75应答率:在第16周时,Deucravacitinib组 VS 安慰剂组 VS apremilast组为58% VS 13% VS 35%;在第24周时,Deucravacitinib组 VS apremilast组为69% VS 38%。
PASI 90应答率:在第16周时,Deucravacitinib组 VS 安慰剂组 VS apremilast组为36% VS 4% VS 20%;在第24周时,Deucravacitinib组 VS apremilast组为42% VS 22%。
PASI 100应答率:在第16周时,Deucravacitinib组 VS 安慰剂组为14% VS 1%。
sPGA 0/1应答率:在第16周时,Deucravacitinib组 VS 安慰剂组 VS apremilast组为54% VS 7% VS 32%;在第24周时,Deucravacitinib组 VS apremilast组为59% VS 31%。
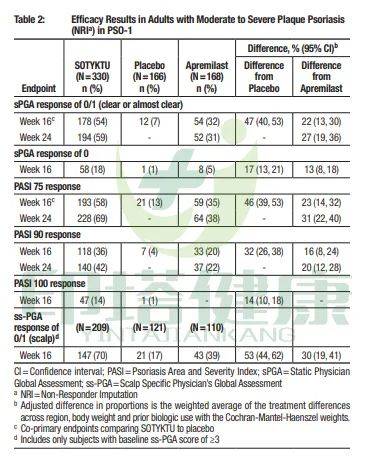
图注:Deucravacitinib治疗中重度斑块状银屑病PEOTYK PSO-1试验疗效数据
2
PEOTYK PSO-2试验
PASI 75应答率:在第16周时,Deucravacitinib组 VS 安慰剂组 VS apremilast组为53% VS 9% VS 40%;在第24周时,Deucravacitinib组 VS apremilast组为58% VS 38%。
PASI 90应答率:在第16周时,Deucravacitinib组 VS 安慰剂组 VS apremilast组为27% VS 3% VS 18%;在第24周时,Deucravacitinib组 VS apremilast组为32% VS 20%。
PASI 100应答率:在第16周时,Deucravacitinib组 VS 安慰剂组为10% VS 1%。
sPGA 0/1应答率:在第16周时,Deucravacitinib组 VS 安慰剂组 VS apremilast组为50% VS 9% VS 34%;在第24周时,Deucravacitinib组 VS apremilast组为49% VS 30%。
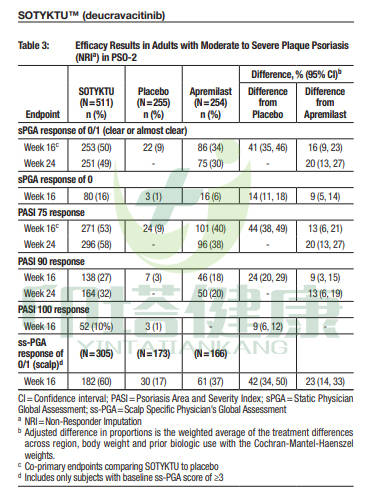
图注:Deucravacitinib治疗中重度斑块状银屑病PEOTYK PSO-2试验疗效数据
综上所述,Deucravacitinib与安慰剂和apremilast相比显示出强大疗效:包括在共同主要终点方面优于安慰剂,在关键次要终点方面优于apremilast。除PAS175和sPGA 0/1指标外,在这两项研究的多个次要终点中,Deucravacitinib均优于apremilast ,表明在症状负担和生活质量指标方面有显著和临床意义的疗效改善。
不良反应
在联合临床试验(PSO-1和PSO-2)的16周安慰剂对照期,接受Deucravacitinib的受试者因不良反应而中止治疗的比例为2.4%,而安慰剂为3.8%。
Deucravacitinib治疗组的最常见的不良反应包括:上呼吸道感染(19.2%)、血磷酸肌酸激酶升高(2.7%)、单纯性疱疹(2.0%)、口腔溃疡(1.9%)、毛囊炎(1.7%)、痤疮(1.4%)。
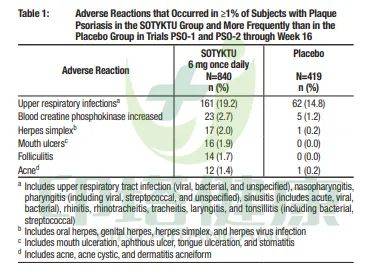
图注:Deucravacitinib治疗中重度斑块状银屑病患者的不良反应
警告和注意事项
超敏反应
感染
肺结核
恶性肿瘤(包括淋巴瘤)
横纹肌溶解症和无症状肌酸磷酸激酶(CPK)升高
实验室异常
免疫接种
与JAK抑制相关的潜在风险
参考来源:
https://packageinserts.bms.com
https://www.rxlist.com
【重要提示】本公号【全球好药资讯】所有文章信息仅供参考,具体治疗谨遵医嘱!



