百济神州第三款自主研发的抗癌新药帕米帕利正式获批
2021年5月7日,中国国家药品监督管理局(NMPA)批准帕米帕利胶囊上市,用于既往经过二线及以上化疗的伴有胚系BRCA(gBRCA)突变的复发性晚期卵巢癌、输卵管癌或原发性腹膜癌患者的治疗。据悉,这是百济神州继泽布替尼和替雷利珠单抗后在中国获批上市的第三款自主研发的抗癌新药。
卵巢癌是中国女性常见癌症之一,超六成的卵巢癌患者在确诊时已为晚期。在卵巢癌患者中,九成以上患有上皮性卵巢癌,其中约70%的上皮性卵巢癌患者在接受一线疗法并获得完全缓解后,仍将出现复发性疾病。
帕米帕利是一种PARP-1和PARP-2的强效、选择性抑制剂。它通过抑制肿瘤细胞DNA单链损伤的修复和同源重组修复缺陷,对肿瘤细胞起到合成致死的作用,尤其对携带BRCA基因突变的DNA修复缺陷型肿瘤细胞敏感度高。
商品名:百汇泽
通用名:pamiparib(帕米帕利)
代号:BGB-290
靶点:PARP-1、PARP-2
临床数据
此次获批是基于一项 I/II期临床试验(NCT03333915)的关键性II期部分临床结果。该研究在中国共纳入了113 例既往接受过至少两项标准化疗、伴有 gBRCA突变的高级别上皮性卵巢癌(包括输卵管癌或原发性腹膜癌)患者,包括90例晚期铂敏感卵巢癌(PSOC)患者和23例晚期铂耐药卵巢癌(PROC)患者。在21天治疗周期中,患者接受了帕米帕利每日两次口服用药、每次60mg的治疗。
该研究的主要终点为经独立审查委员会(IRC)基于实体瘤疗效评价标准1.1版评估的客观缓解率(ORR)。
有效性数据是基于101例疗效可评估患者,其中包括 82 例铂敏感卵巢癌患者和 19 例铂耐药患者。
研究数据表明:在晚期铂敏感卵巢癌患者中,中位随访时间为17个月,客观缓解率(ORR)为68.3%,中位缓解持续时间(DoR)为13.8个月;
在晚期铂耐药卵巢癌患者中,中位随访时间为11.6个月,ORR为31.6%,中位DoR 为11.1个月。
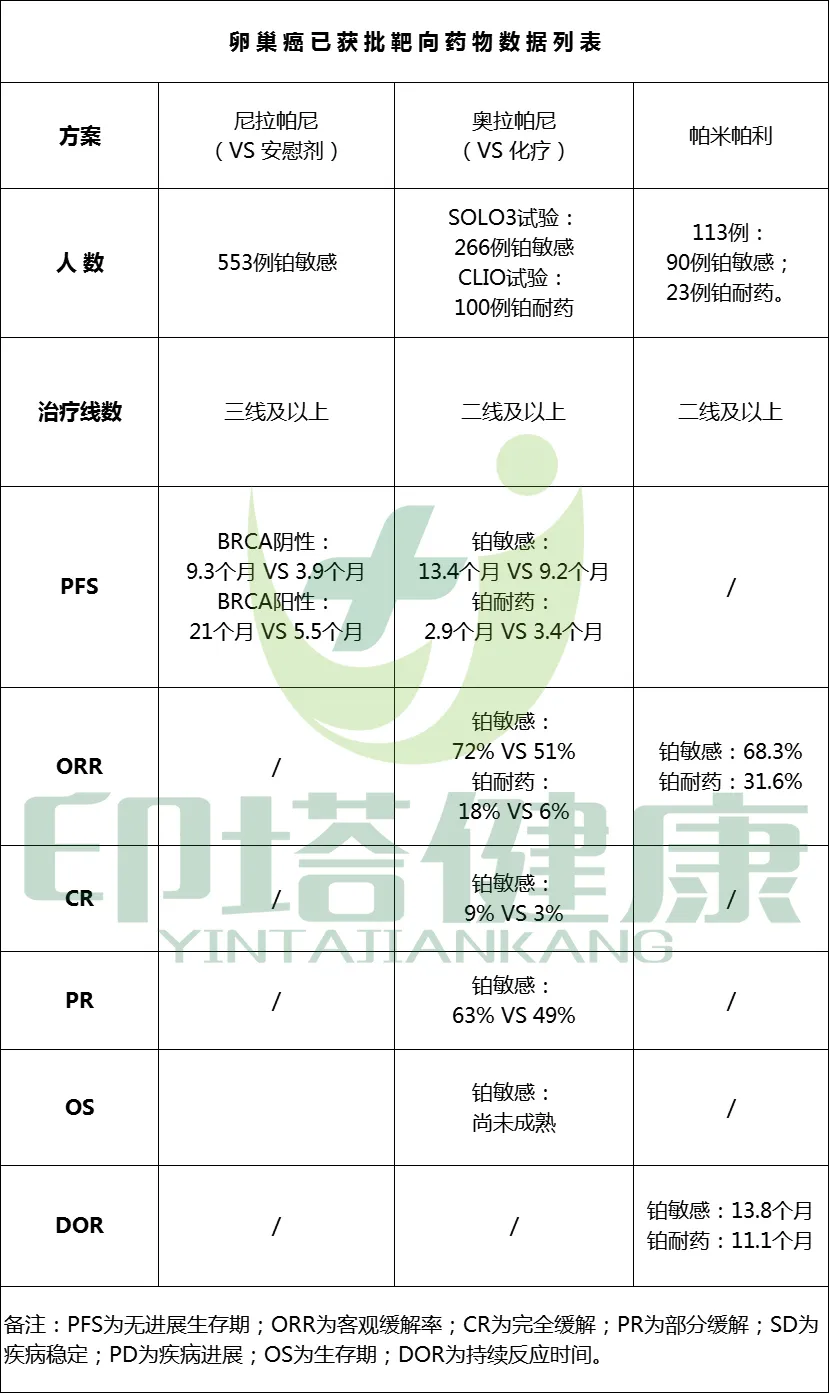
图注:卵巢癌已获批靶向药物数据列表
不良反应
在中国报告的最常见不良反应(≥10%)为贫血、白细胞减少、恶心、中性粒细胞减少、呕吐、血小板减少、食欲减退、疲乏、腹痛、ALT升高、腹泻、AST升高、淋巴细胞减少症、γ-谷氨酰转移酶增加、上呼吸道感染、血胆红素增加、不适、体重下降和头晕。
71.7%的患者经历了三级及以上不良反应,最常见(≥1%)为贫血、中性粒细胞减少、白细胞减少、血小板减少、淋巴细胞减少、呕吐、腹泻、γ-谷氨酰转移酶升高、低血钾、腹痛、疲乏、上呼吸道感染、全血细胞减少和高血压。
结论
这项关键II期临床试验数据令人欣喜,展现了帕米帕利能为铂敏感或铂耐药患者带来具有临床意义且持久的缓解。此次上市为复发性晚期卵巢癌、输卵管癌或原发性腹膜癌患者提供了新的治疗选择。
目前,帕米帕利正作为单一疗法或与其他药物联用治疗多种恶性实体瘤进行全球临床开发,涉及前列腺癌、乳腺癌、胃癌、输卵管癌、原发性腹膜癌等多种癌症。
【重要提示】本公号【全球好药资讯】所有文章信息仅供参考,具体治疗谨遵医嘱!



